Índice
La valencia en química se refiere a la capacidad que tiene un átomo para combinarse con otros átomos. Los átomos buscan formar moléculas estables al compartir o transferir electrones, y la valencia es la medida de esa capacidad de combinación.
Cada átomo tiene una capa externa de electrones llamada capa de valencia. La mayoría de los átomos buscan tener una configuración de electrones similar a la de los gases nobles (como el helio, neón o argón), que son muy estables. Para lograr esto, los átomos pueden perder, ganar o compartir electrones.

La valencia de un átomo indica cuántos electrones puede ganar, perder o compartir para alcanzar una configuración electrónica más estable. Por ejemplo, el hidrógeno tiene una valencia de 1, lo que significa que puede compartir un electrón. El oxígeno tiene una valencia de 2, lo que indica que puede compartir dos electrones o aceptar dos electrones de otros átomos.
Cabe diferenciar las valencias de los electrones de valencia, pues los electrones de valencia de la tabla periódica designan la cantidad de electrones que se encuentran en la órbita más externa del elemento.
A continuación, te presentamos un esquema de valencias de los elementos químicos de la tabla periódica dividido en grupos. Así, podrás conocer la tabla de valencias de cada uno de los grupos de elementos químicos.
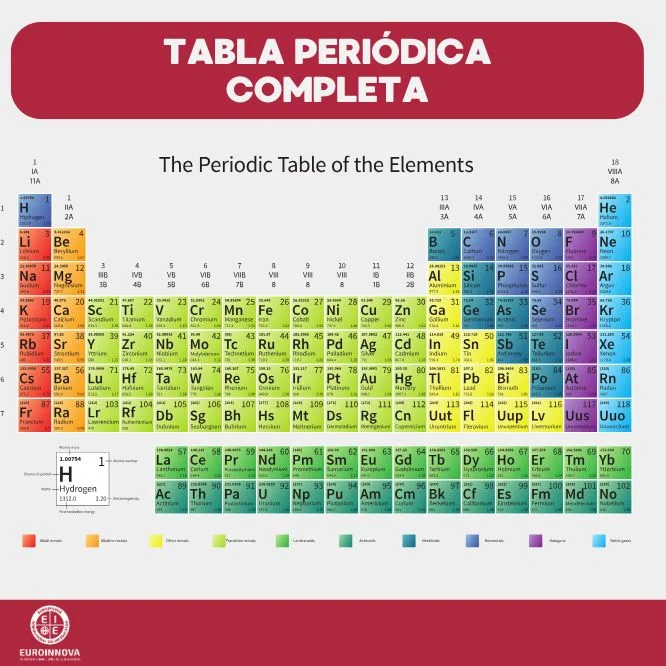
Los elementos alcalinos, pertenecientes al grupo 1 de la tabla periódica, son metales altamente reactivos con un único electrón de valencia en su capa externa. Su reactividad se manifiesta especialmente al entrar en contacto con el agua, generando soluciones básicas y liberando hidrógeno. Entre los alcalinos más conocidos se encuentran el sodio y el potasio, que se emplean en diversas aplicaciones industriales y biológicas.
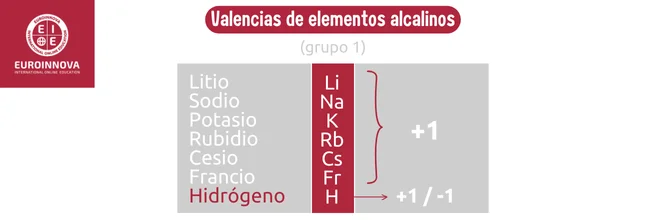
Los alcalinotérreos, ubicados en el grupo 2, son metales que comparten características con los alcalinos pero con dos electrones de valencia en su capa externa. El calcio y el magnesio son ejemplos comunes de alcalinotérreos y son esenciales en procesos biológicos y en la construcción de materiales como el yeso.
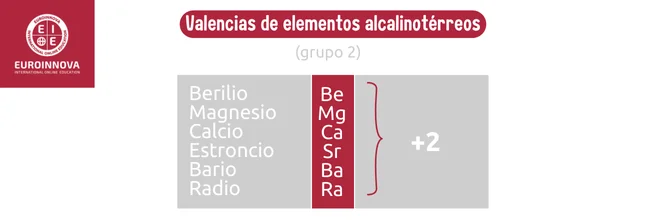
Los anfígenos comprenden elementos como oxígeno y azufre, ubicados en los grupos 16 y 17. Estos elementos poseen la capacidad de formar compuestos con otras sustancias, actúan como oxidantes o reductores, y se emplean en reacciones ácido-base.
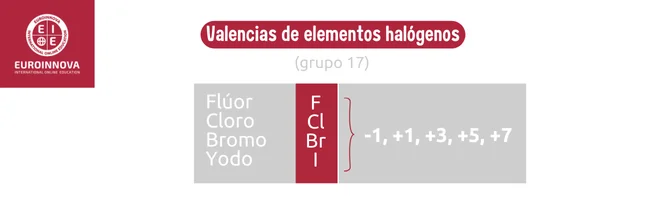
Los halógenos, pertenecientes al grupo 17, incluyen elementos altamente reactivos como el flúor y el cloro que buscan ganar un electrón para completar su configuración electrónica y adquirir una carga negativa. Se aplican muy frecuentemente para desinfectar el agua, como es el caso del cloro.
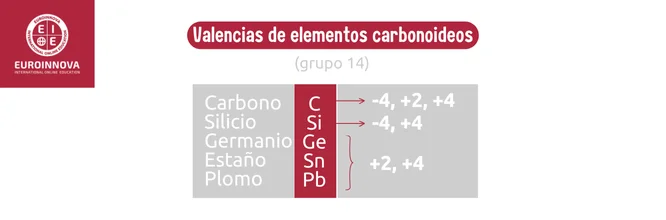
Los carbonoideos, como el carbono y el silicio, exhiben propiedades intermedias entre metales y no metales, y son esenciales para la vida y el desarrollo de la tecnología. Por ejemplo, el silicio se implementa en la fabricación de materiales semiconductores.
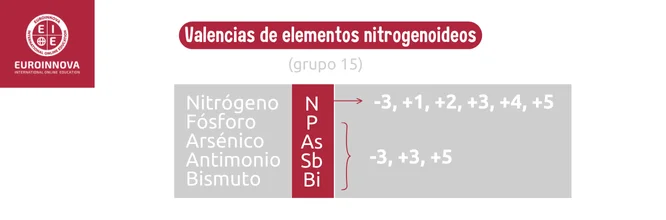
Los nitrogenoideos, que incluyen nitrógeno, fósforo y otros elementos del grupo 15, participan en la formación de compuestos con valencias variables. Por ejemplo, las valencias del nitrógeno son -3, 1, 2, 3, 4, 5, mientras que las valencias del fósforo son -3, +3 y +5.
Los boroideos, como el boro y el aluminio, comparten propiedades con los elementos del grupo 13.

Los actínidos y lantánidos son dos series de elementos que se encuentran en las partes inferiores de la tabla periódica. Los actínidos, como el uranio y el plutonio, son conocidos por su radiactividad y se han utilizado en aplicaciones nucleares. Por su parte, los lantánidos, como el lantano y el gadolinio, comparten propiedades similares y tienen usos variados, desde tecnologías de imanes hasta la producción de pantallas LED.


Los elementos de transición constituyen la mayoría de la tabla periódica y presentan propiedades metálicas conocidas a nivel general. Estos elementos tienen diversas valencias y juegan un papel crucial en la formación de compuestos que se emplean con frecuencia en la industria y la tecnología.

Los gases nobles son conocidos por su alta estabilidad y, por lo tanto, no forman enlaces químicos con otros átomos. Esto se debe a que tienen una configuración electrónica completa en sus capas exteriores. Las valencias de los gases nobles, en términos de formación de compuestos, son generalmente cero, ya que no tienden a ganar, perder ni compartir electrones en reacciones químicas.
Así pues, las valencias del helio, neón, argón, kriptón, xenón y radón suelen equivaler a cero.
Puede que te interese leer sobre:

¡Muchas gracias!
Hemos recibido correctamente tus datos. En breve nos pondremos en contacto contigo.