Índice
Autor: Miriam González Ferrero
La calidad embrionaria es uno de los factores determinantes en el éxito de las técnicas de reproducción asistida, debido a que condiciona el potencial de implantación post-transferencia. Actualmente, el método para seleccionar embriones de mejor calidad se basa en la valoración de criterios morfológicos mediante observaciones puntuales del desarrollo embrionario. No obstante, este sistema de evaluación es subjetivo y produce controversia, por lo que no es totalmente fiable. Debido a la importancia de transferir embriones viables en los tratamientos de reproducción, este trabajo pretende investigar nuevas técnicas de evaluación de la calidad embrionaria previa a la implantación, que reemplacen o complementen a la clasificación morfológica convencional, con el objetivo de optimizar la selección de embriones. Para ello, se realizó una búsqueda de artículos científicos relacionados con el tema central de esta investigación en fuentes bibliográficas como PubMed o Google Scholar.
Los principales resultados de esta revisión muestran que se han desarrollado métodos ómicos no invasivos, que analizan diversas moléculas secretadas por el embrión al medio de cultivo, para predecir la calidad embrionaria. Otro hallazgo obtenido es la monitorización del desarrollo embrionario mediante imágenes time-lapse, que permiten evaluar la morfocinética del embrión. El uso de algoritmos computacionales para predecir el potencial implantatorio es otra de las nuevas técnicas de evaluación que proporciona gran precisión. Como conclusión, la construcción de un modelo predictivo de gestación mediante inteligencia artificial, que incluya datos ómicos, información time-lapse y características de los pacientes, aportaría resultados prometedores en el ámbito de la evaluación y selección embrionaria.
-1686035096.webp)
La calidad embrionaria se define como el potencial del embrión para implantarse en el útero y producir un embarazo que llegue a término con el nacimiento de un bebé sano (Rodríguez et al., 2017).
El protocolo habitual para la valoración de la calidad de los embriones atiende a unos criterios morfológicos definidos. Los embriólogos clínicos realizan múltiples observaciones a lo largo del desarrollo embrionario, con unos intervalos de tiempo establecidos (ASEBIR, 2015). Esta evaluación es fundamental para la idónea decisión clínica respecto al destino del embrión, pudiendo ser seleccionado para transferencia o criopreservación (Mizuno et al., 2021).
Así, dependiendo de las variables morfológicas, se asigna al embrión en una de las categorías del sistema de gradación, que se dividen según el potencial implantatorio (ASEBIR, 2015; Gómez y Rojas, 2021):
Principalmente, la clasificación morfológica embrionaria se realiza en el segundo o tercer día de cultivo (D+2 o D+3) o bien en etapa de blastocisto (D+5 o D+6). La observación de la morfología en los días restantes de cultivo (ovocito D+0, zigoto D+1, mórula D+4) pueden ayudar a la categorización embrionaria, a pesar de la falta de consenso sobre las características relevantes para la valoración de la calidad en estos estadios de desarrollo (ASEBIR, 2015).
Para evaluar embriones D+2 y D+3, se observa el ritmo de división celular, siendo lo ideal que el embrión presente cuatro células en D+2 y siete u ocho células en D+3. Además, se valora que el porcentaje de fragmentación sea mínimo (Figura 1A-C), que haya ausencia de vacuolas (Figura 1D), que la simetría celular sea estadio-específico y que no presente micronúcleos (Figura 1E) o alguna alteración en la zona pelúcida (Figura 1F-H) o en el citoplasma (ASEBIR, 2015).
Figura 1. Valoración en D+2 y en D+3
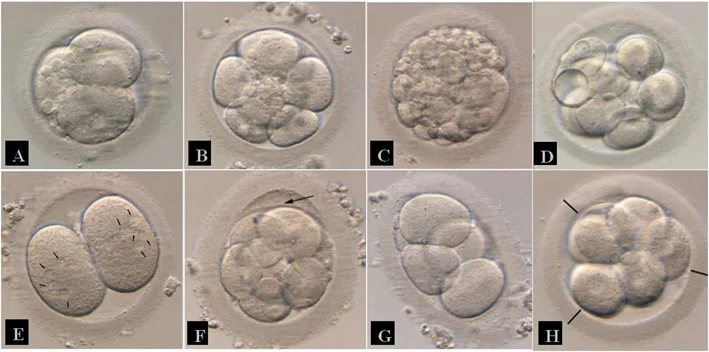
Nota. (A) Embrión de cuatro células con fragmentación aproximada del 10%. (B) Embrión de ocho células con fragmentación aproximada del 10%. (C) Embrión con fragmentación mayor al 50%. (D) Presencia de vacuolas en menos del 50% de las células embrionarias. (E) Presencia de micronucleación en las células embrionarias. Las flechas señalan la posición de los micronúcleos. (F) Embrión con zona pelúcida septada. (G) Embrión con zona pelúcida no circular. (H) Embrión con zona pelúcida demasiado homogénea, con medidas del grosor muy similares. De “Criterios ASEBIR de Valoración Morfológica de Oocitos, Embriones Tempranos y Blastocitos Humanos” por Asociación para el Estudio de la Biología de la Reproducción, 2015, Cuadernos de Embriología Clínica, 3º edición.
En la categorización de embriones D+5 y D+6, se deben valorar las diferentes estructuras que presenta el blastocisto (Figura 2A). En concreto, se observa tanto las características del trofoectodermo y de la masa celular interna como el grado de expansión del blastocele (Figura 2B-C) y el grosor de la zona pelúcida. Asimismo, la presencia de vacuolas y la fragmentación indican una mala morfología embrionaria (ASEBIR, 2015).
Figura 2. Valoración en D+5 y en D+6
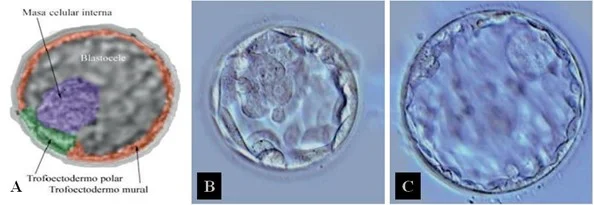
Nota (A) Morfología propia del embrión en estadio de blastocisto. (B) Blastocisto en expansión. (C) Blastocisto expandido. De “Criterios ASEBIR de Valoración Morfológica de Oocitos, Embriones Tempranos y Blastocitos Humanos” por Asociación para el Estudio de la Biología de la Reproducción, 2015, Cuadernos de Embriología Clínica, 3º edición.
Desde los inicios de la fecundación in vitro, se aplica la evaluación morfológica como método de selección embrionaria, no obstante éste presenta ciertas limitaciones.
Aunque la Asociación para el Estudio de la Biología de la Reproducción (ASEBIR) estandarizó unos criterios morfológicos para clasificar los embriones humanos (Pons et al., 2021), no existe un consenso aceptado por todas las diversas sociedades científicas internacionales. Además, solo pueden compararse embriones en la misma etapa de desarrollo (Mizuno et al., 2021). Otro problema de este método de evaluación es que está sesgado por la subjetividad del examinador y aunque existen varias pautas para estandarizar la clasificación, los resultados no son completamente fiables (Rocha et al., 2016). Asimismo, para observar la morfología del embrión se alteran las condiciones de cultivo, puesto que los embriones han de extraerse de los incubadores en los que se encuentran bajo condiciones controladas de pH, luz, temperatura, humedad y oxígeno (Vallejos et al., 2021).
De modo que, actualmente, hay una gran necesidad por descubrir nuevos métodos de valoración de la calidad embrionaria que sean prácticos y no invasivos y, principalmente, que aporten precisión y objetividad.
La calidad de los embriones puede verse afectada por diversos factores, los cuales son capaces de interferir en el desarrollo embrionario. Asimismo, estos factores se clasifican en intrínsecos y extrínsecos.
El factor intrínseco principal es la calidad de los gametos, tanto la del espermatozoide como la del óvulo (Colaco y Sakkas, 2018; Rodríguez et al., 2017). Éstos, a su vez, dependen de la edad, del índice de masa corporal y de otras condiciones de los progenitores, como puede ser presentar varicocele o padecer endometriosis (Bashiri et al., 2021; Colaco y Sakkas, 2018; Góngora-Rodríguez y Fontanilla-Ramírez, 2010).
Como factores extrínsecos se encuentran las condiciones de cultivo de los embriones y la infraestructura del laboratorio (Günther et al., 2022; Rodríguez et al., 2017).
En definitiva, es de gran importancia investigar los factores que alteran esta calidad embrionaria y disminuyen las tasas de éxito en las clínicas reproductivas, ya que se podría actuar sobre los factores modificables para obtener así embriones de mayor calidad.
Se pretende alcanzar el siguiente objetivo general:
Se proponen los siguientes objetivos específicos:
1.1. Investigar y exponer los nuevos métodos existentes para evaluar la calidad embrionaria.
1.2. Comparar los nuevos métodos de clasificación con los criterios morfológicos habituales que rigen la clasificación de la calidad embrionaria.
1.3. Exponer métodos de actuación para interferir en los principales factores intrínsecos y extrínsecos que afectan a la calidad embrionaria.
Se busca dar respuesta a la pregunta de investigación: ¿Cuáles son los procedimientos más prometedores que deben complementar o sustituir a los criterios actuales de categorización de la calidad embrionaria en el laboratorio?
Para lograr los objetivos de este estudio, se realizó una búsqueda exhaustiva y no sesgada de la literatura sobre “evaluación de la calidad embrionaria” y “factores influyentes en la calidad embrionaria” en PubMed, Google Scholar y SciELO.
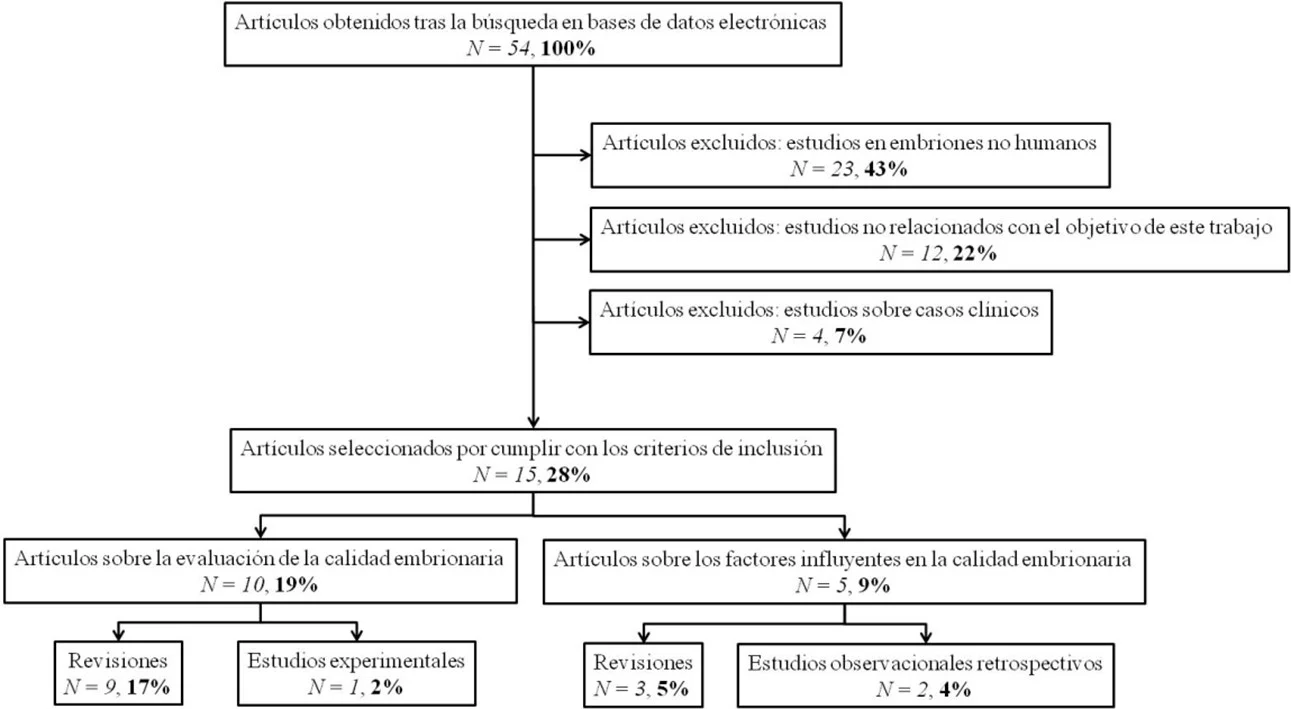
Se encontraron 54 artículos relacionados con los criterios de búsqueda. Después, se comprobó que no presentaban ningún criterio de exclusión, los cuales fueron: que los artículos se tratasen de estudios en embriones no humanos, que se refiriesen a casos clínicos concretos y que no guardasen relación con la pregunta de investigación. Se recogieron publicaciones del 2013 en adelante, sin hacer ninguna restricción en cuanto al idioma.
Finalmente, se incluyeron 10 artículos sobre nuevas metodologías para evaluar la calidad embrionaria y 5 artículos sobre los factores que afectan a la calidad embrionaria. Estos artículos seleccionados comprenden tanto revisiones como estudios experimentales y estudios observacionales retrospectivos (Figura 3).
Figura 3. Estrategia de búsqueda
Se han desarrollado nuevos métodos no invasivos de selección en diversos campos, como la genómica, la transcriptómica, la proteómica y la metabolómica, también conocidas como las ómicas. Éstas se basan en el análisis de moléculas secretadas por el embrión en el medio de cultivo para predecir la calidad embrionaria.
Los métodos proteómicos se centran en la espectrometría de masas, donde se identifican proteínas del secretoma que se asocian a un pronóstico positivo o negativo del embarazo (Hernández-Vargas et al., 2020; Rødgaard et al., 2015). Mediante espectroscopia de infrarrojo cercano (NIR), se estudia el metaboloma secretado, el cual sería un buen indicativo de la actividad intracelular y podría utilizarse como biomarcador para embriones con alta probabilidad de implantación (Rødgaard et al., 2015; Thompson et al., 2016). Recientemente, ha surgido la evaluación de los tipos y cantidades de microARN (miARN) secretados en el medio embrionario usando qPCR (Hernández-Vargas et al., 2020; Rødgaard et al., 2015). También se han identificado ciertos factores genéticos que podrían emplearse como potenciales marcadores moleculares de viabilidad embrionaria; por medio de hibridación genómica comparativa (CGH) y secuenciación de nueva generación (NGS) se logra examinar todo el genoma embrionario (Sang et al., 2021).
La tecnología TL captura imágenes del embrión cada 5-20 minutos, en diferentes planos focales, así genera un vídeo gracias a un software propio, lo que permite la monitorización del desarrollo embrionario. La evaluación morfológica del desarrollo embrionario se realiza en incubadoras dotadas de microscopio y cámaras de grabación de imágenes, a través de una pantalla desde el exterior de la incubadora. Además, el software registra las variables morfocinéticas, que son las características morfológicas y de escisión en momentos específicos del desarrollo embrionario, algunas de las cuales podrían ser marcadores predictivos de la viabilidad embrionaria (Lundin y Park, 2020; Vallejos et al., 2021).
Mediante IA, se elaboran modelos computacionales predictivos de gestación que emplean algoritmos de aprendizaje automático profundo para la selección embrionaria (Kragh y Karstoft, 2021).
Las redes neuronales convolucionales destacan en el estudio de embriones (Dimitriadis et al., 2022). Se han desarrollado varios modelos IA para predecir la calidad de los embriones, utilizando imágenes estáticas e imágenes TL con sus anotaciones morfocinéticas y considerando factores relevantes en fertilidad, como la edad, y datos ómicos del embrión (Dimitriadis et al., 2022; Kragh y Karstoft, 2021; Vallejos et al., 2021).
La buena calidad embrionaria aumenta con un mayor número de ovocitos aspirados, mientras que la edad avanzada de los progenitores y la infertilidad de causa desconocida afectan negativamente a la calidad embrionaria (Bashiri et al., 2021; Günther et al., 2022; Rodríguez et al., 2017). El factor más importante que compromete la calidad embrionaria es la edad materna (Günther et al., 2022). Sin embargo, no se puede actuar sobre ésta, al igual que sucede con los pacientes que presentan infertilidad de causa inexplicable. Por otro lado, para conseguir un mayor número de ovocitos se recomienda la estimulación ovárica con gonadotropinas y análogos de GnRH, ya que se originan un mayor número de folículos maduros en el momento de la punción ovárica (Rodríguez et al., 2017).
El daño en los gametos se asocian a mutaciones y a diversas condiciones médicas, pero también al estilo de vida, como la obesidad y el tabaquismo (Bashiri et al., 2021; Broughton y Moley, 2017; Günther et al., 2022). De modo que, un protocolo de actuación sería modificar los hábitos de vida de los progenitores a unos que fomenten una mejor salud reproductiva, como la dieta mediterránea con ingesta de antioxidantes y el ejercicio físico moderado, con el objetivo de mantener un IMC entre 18,5 y 25 (Bashiri et al., 2021; Broughton y Moley, 2017).
En cuanto a los factores extrínsecos, se recomienda sustituir medios de un solo paso por un cultivo secuencial, donde el medio de cultivo se cambia el día 3 para adaptarse a los requisitos fisiológicos del momento (Günther et al., 2022). Una baja concentración de antibióticos en el medio también es necesaria, ya que evita el crecimiento de microorganismos (Poletto et al., 2018). Además, los embriones cultivados en una concentración de oxígeno del 5% se relacionan con mayores tasas de implantación (Günther et al., 2022).
Asimismo, se ha demostrado que las sustancias contaminantes en el ambiente tienen efectos nocivos sobre el desarrollo embrionario, por lo que se debe instalar un sistema de aire acondicionado que mantenga una presión positiva en la sala de procedimientos mediante filtros de aire de tipo de partículas de aire de alta eficiencia (HEPA) y carbón activo. Además, se debe controlar que la temperatura esté entre 23 y 27ºC, la humedad relativa del aire se encuentre entre 40 y 70%, y la realización de cuidados asépticos y descontaminantes para reducir la contaminación microbiológica. En consecuencia, el establecimiento de un control de gestión de calidad es importante para alcanzar y mantener unas condiciones óptimas y seguras en el laboratorio, y con ello optimizar los resultados clínicos (Poletto et al., 2018).
Una de las principales causas que impide la mejora en las tasas de éxito es la ausencia de un sistema óptimo de evaluación de la calidad embrionaria.
De este modo, han surgido varias técnicas basadas en el análisis molecular del medio de cultivo embrionario. El volumen de medio varía de 15 a 40 μl, por lo que este método debe ser muy sensible, ya que las moléculas a analizar están presentes a bajas concentraciones (Hernández-Vargas et al., 2020; Rødgaard et al., 2015). Con la tecnología NIR se pueden medir volúmenes de muestras incluso menores a 15 μl, sin necesidad de preparar la muestra y obteniendo los resultados en pocos minutos, al igual que la qPCR, aunque ésta sí requiere pretratamiento de la muestra (Rødgaard et al., 2015). Por otra parte, el conocimiento de biomarcadores moleculares asociados con el potencial de implantación embrionario es muy reducido (Hernández-Vargas et al., 2020; Kaihola et al., 2019; Rødgaard et al., 2015). Además, se ha observado que la presencia de albúmina como fuente proteica en el medio de cultivo interfiere en la detección de proteínas que presentan un peso molecular similar ésta, es decir, 65 kDa (Rødgaard et al., 2015). Teniendo en cuenta estas limitaciones, el perfil metabólico por NIR es el método ómico más prometedor para aplicar en clínica debido a su bajo costo, rapidez y fácil manejo.
Actualmente, los novedosos dispositivos TL mantienen unas condiciones de cultivo estables, debido a que permiten visualizar de forma ininterrumpida el desarrollo embrionario sin extraer al embrión (Findikli y Oral, 2014; Lundin y Park, 2020; Vallejos et al., 2021). De igual manera, se realiza un seguimiento continuo del desarrollo embrionario, así pues no se ignoran eventos significativos (Findikli y Oral, 2014; Lundin y Park, 2020). Sin embargo, esta evaluación continúa siendo una intervención subjetiva y manual por parte del embriólogo. Además, el análisis de las imágenes TL requieren un tiempo considerable y el sistema de cultivo cerrado es bastante costoso (Lundin y Park, 2020).
Por otro lado, los modelos computacionales superan la valoración subjetiva de la calidad embrionaria (Dimitriadis et al., 2022; Findikli y Oral, 2014; Lundin y Park, 2020). La IA es una herramienta que se caracteriza por su elevada precisión, reproducibilidad y velocidad (Dimitriadis et al., 2022; Kragh y Karstoft, 2021). No obstante, esta tecnología presenta ciertas limitaciones, ya que define rangos de tiempo muy concretos para seleccionar los embriones (Findikli y Oral, 2014). Además, es importante el tamaño del conjunto de datos y que éstos estén equilibrados para suprimir el sesgo en el aprendizaje del algoritmo IA (Dimitriadis et al., 2022; Kragh y Karstoft, 2021). Otra gran limitación es que los modelos IA publicados no son universales (Findikli y Oral, 2014; Lundin y Park, 2020; Vallejos et al., 2021).
En cuanto a los métodos de intervención para modificar los factores clínicos que influyen en la calidad embrionaria, la estimulación ovárica puede presentar una grave complicación conocida como el síndrome de hiperestimulación ovárica (Günther et al., 2022). No obstante, una de las propuestas más eficaz y sencilla de realizar para elevar la calidad de los gametos es cambiar los hábitos perjudiciales de los pacientes a unos saludables (Bashiri et al., 2021; Broughton y Moley, 2017).
Además, las mejoras en el medio de cultivo embrionario y en el equipamiento del laboratorio mantienen un entorno de trabajo seguro que imita las condiciones in vivo de los embriones humanos, lo cual permite conservar la calidad embrionaria (Poletto et al., 2018).
La elaboración de un algoritmo IA que combine información de metodologías innovadoras, como parámetros morfocinéticos TL y datos ómicos de los embriones, con detalles de la historia clínica de los pacientes, como la edad o el IMC, resulta el método más prometedor de evaluación y selección embrionaria.
La técnica convencional para evaluar la calidad embrionaria, basada en analizar las características morfológicas del embrión mediante observaciones puntuales a microscopio, está fuertemente sesgada por la subjetividad del examinador; a diferencia de los nuevos métodos de evaluación mencionados, que superan esta gran limitación.
Las principales y básicas medidas de actuación para mejorar la calidad de los embriones son el mantenimiento de unos hábitos de vida saludables en los pacientes y la conservación de unas condiciones apropiadas tanto en el medio de cultivo embrionario como en el ambiente clínico del laboratorio de reproducción.
Asociación para el Estudio de la Biología de la Reproducción. (2015). Criterios ASEBIR de Valoración Morfológica de Oocitos, Embriones Tempranos y Blastocitos Humanos. Cuadernos de Embriología Clínica. 3º edición.
Bashiri Z, Amidi F, Amiri I, Zandieh Z, Maki CB, Mohammadi F, Amiri S, Koruji M. (2021). Male Factors: the Role of Sperm in Preimplantation Embryo Quality. Reprod Sci, 28(7), 1788-1811. doi: 10.1007/s43032-020-00334-z.
Broughton DE, Moley KH. (2017). Obesity and female infertility: potential mediators of obesitys impact. Fertil Steril, 107(4), 840-847. doi: 10.1016/j.fertnstert.2017.01.017.
Colaco S, Sakkas D. (2018). Paternal factors contributing to embryo quality. J Assist Reprod Genet, 35(11), 1953-1968. doi: 10.1007/s10815-018-1304-4.
Dimitriadis I, Zaninovic N, Badiola AC, Bormann CL. (2022). Artificial intelligence in the embryology laboratory: a review. Reprod Biomed Online, 44(3), 435-448. doi: 10.1016/j.rbmo.2021.11.003.
Findikli N, Oral E. (2014). Time-lapse embryo imaging technology: does it improve the clinical results? Curr Opin Obstet Gynecol, 26(3), 138-44. doi: 10.1097/GCO.0000000000000072.
Gómez FSA, Rojas QPR. (2021). Incrementando calidad y seleccionando el mejor embrión. Medisur, 19(1), 1-3.
Góngora-Rodríguez A, Fontanilla-Ramírez D. (2010). La fragmentación de ADN espermático, influencia sobre las técnicas de reproducción asistida y la calidad embrionaria. Revista Colombiana de Obstetricia y Ginecología, 61(2), 160-164. doi: 10.18597/rcog.285.
Günther V, Dasari-Mettler A, Mettler L, Otte SV, Ackermann J, Maass N, Alkatout I. (2022). Is Blastocyst Culture Responsible for Higher Pregnancy Rates? A Critical Analysis of the Day of Optimal Embryo Transfer and Embryo Quality. JBRA Assist Reprod, 26(3), 492-499. doi: 10.5935/1518-0557.20210098.
Hernández-Vargas P, Muñoz M, Domínguez F. (2020). Identifying biomarkers for predicting successful embryo implantation: applying single to multi-OMICs to improve reproductive outcomes. Hum Reprod Update, 26(2), 264-301. doi: 10.1093/humupd/dmz042.
Kaihola H, Yaldir FG, Bohlin T, Samir R, Hreinsson J, Åkerud H. (2019). Levels of caspase-3 and histidine-rich glycoprotein in the embryo secretome as biomarkers of good-quality day-2 embryos and high-quality blastocysts. PLoS One, 14(12), e0226419. doi: 10.1371/journal.pone.0226419.
Kragh MF, Karstoft H. (2021). Embryo selection with artificial intelligence: how to evaluate and compare methods? J Assist Reprod Genet, 38(7), 1675-1689. doi: 10.1007/s10815-021-02254-6.
Lundin K, Park H. (2020). Time-lapse technology for embryo culture and selection. Ups J Med Sci, 125(2), 77-84. doi: 10.1080/03009734.2020.1728444.
Mizuno S, Matsumoto H, Hashimoto S, Brahmajosyula M, Ohgaki A, Tarui S, Matoba M, Satoh M, Fukuda A, Morimoto Y. (2021). A novel embryo quality scoring system to compare groups of embryos at different developmental stages. J Assist Reprod Genet, 38(5), 1123-1132. doi: 10.1007/s10815-021-02117-0.
Poletto KQ, de Lima YAR, Approbato MS. (2018). Effect of the Air Filtration System Replacement on Embryo Quality in the Assisted Reproduction Laboratory. Rev Bras Ginecol Obstet, 40(10), 625-630. doi: 10.1055/s-0038-1670715.
Pons MC, Carrasco B, Rives N, Delgado A, Martínez-Moro A, Cuevas I, Cairó O. (2021, noviembre 18). Estudio multicéntrico para la validación del criterio ASEBIR de valoración morfológica de blastocistos [Ponencia sesión embriología]. XI Congreso ASEBIR, Toledo, España. Revista de Embriología Clínica y Biología de la Reproducción, 26(2), 33-37.
Rocha JC, Passalia F, Matos FD, Maserati MP Jr, Alves MF, Almeida TG, Cardoso BL, Basso AC, Nogueira MF. (2016). Methods for assessing the quality of mammalian embryos: How far we are from the gold standard? JBRA Assist Reprod, 20(3), 150-8. doi: 10.5935/1518-0557.20160033.
Rødgaard T, Heegaard PM, Callesen H. (2015). Non-invasive assessment of in-vitro embryo quality to improve transfer success. Reprod Biomed Online, 31(5), 585-92. doi: 10.1016/j.rbmo.2015.08.003.
Rodríguez MK, Reyes MIM, Flores SRM, et al. (2017). Factores clínico-terapéuticos y su relación con la calidad embrionaria en pacientes sometidas a fertilización in vitro. Rev Cuba Endoc, 28(1), 1-13.
Sang Q, Zhou Z, Mu J, Wang L. (2021). Genetic factors as potential molecular markers of human oocyte and embryo quality. J Assist Reprod Genet, 38(5), 993-1002. doi: 10.1007/s10815-021-02196-z.
Thompson JG, Brown HM, Sutton-McDowall ML. (2016). Measuring embryo metabolism to predict embryo quality. Reprod Fertil Dev, 28(1-2), 41-50. doi: 10.1071/RD15340.
Vallejos YC, Dacruz BH, Vajellos SC. (2021). Selección de embriones en los tratamientos de fecundación in vitro. Clínica e Investigación en Ginecología y Obstetricia, 49(1), 1-9. doi: 10.1016/j.gine.2021.100709.
Vilches Ferrón MA, Busquets Bonet A. (2017). Aspectos morfológicos en el desarrollo embrionario: Fragmentación y su relación con la calidad embrionaria. Actual Med, 102(801), 93-97. doi: 10.15568/am.2017.801.re02

¡Muchas gracias!
Hemos recibido correctamente tus datos. En breve nos pondremos en contacto contigo.